

細胞外マトリックス(ECM)は、細胞がつくる細胞外環境の中心的な存在です。ECMはレセプター等を介し細胞の機能を調整し、常に細胞へ作用しています。私たちは分子生物学・形態学・発生学などを駆使し、生命原理の追求から臨床への橋渡し研究を行っています。
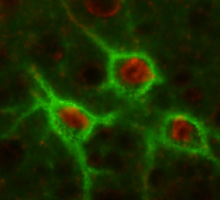
神経細胞はシナプスという接点を介して神経回路を形成し、神経情報の伝達と処理を行っています。脳が成熟期に入ると、特定の神経細胞周囲にコンドロイチン硫酸プロテオグリカンが沈着してきます。
これらはシナプスを取り囲むように存在するため、網目状の構造物(ペリニューロナルネット)を形成します。さらに、その形成や作用がECMだけでなく、分泌タンパク、細胞接着分子、イオンチャンネルなどと共同して働くことも見つかってきています。我々はこれらの神経細胞局所のECM会合体の輪留め楔として重要であるリンクプロテイン遺伝子を欠損させて、その機能をみる手法で研究しています。特定のリンクプロテインが特定のプロテオグリカンの安定化に役立ち、個々の神経細胞に固有のペリニューロナルネットを形成していると考え、研究を進めています。 これらの研究により、「神経糖鎖生物学」という学問を追及していきます。
骨、軟骨は豊富な細胞外マトリックスを含む組織であり、これら細胞外マトリックスが組織の骨組みとなり、組織の性質を決定づけています。関節軟骨に存在する細胞外マトリックスの一つであるアグリカンは多数のコンドロイチン硫酸鎖を分子に含むことから水を多く含み,潤滑剤として働くことが知られており、アグリカンの分解が変形性関節症(OA)の病態進行に関与していると考えられています。我々は、OAにおけるプロテオグリカン分解の初期病変を鋭敏に捉える目的で、軟骨のバイオイメージング研究を、また、それを応用し、軟骨再生に有効な新たな薬剤の探索を推進しています。また、骨形成タンパク質2 (BMP-2)は、骨組織の細胞外マトリックス中に埋め込まれた成長因子であり、強力な骨形成能を有することから、次世代の骨再生療法として期待されています。我々は,本BMP-2の生物学的機能を詳細に検討すると共に、臨床応用に向け研究を推進しています。
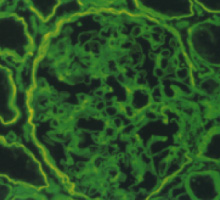
基底膜は様々な細胞の機能(生存、増殖、移動など)を制御しうること、組織によって特有の分子構成であることなどが明らかとなっています。 基底膜の構成分子にはIV型コラーゲン、ラミニン、パーレカン、XVIII型コラーゲンなどの様々な細胞外マトリックス分子が知られています。それらの分子の異常や基底膜構造の破綻は組織特有の機能に大きな影響を与えると考えられます。我々は、特に、血管の物質透過性や血管新生における基底膜の役割を明らかにする基礎研究、さらに、脳血管系や心血管系疾患モデルを用いた研究を行っています。
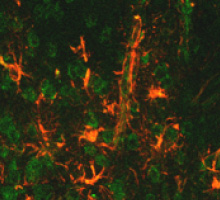
損傷を受けた脊髄や脳では細胞外マトリックスが質的量的に大きく変化することが知られています。中枢神経組織の修復に血液-脳関門の改善や血管新生、瘢痕形成などが重要と考えられており、これらの事象における細胞外マトリックスの役割について解析しています。
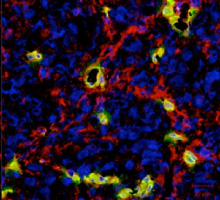
近年がんの研究においても、がん細胞を取り巻く「がん微小環境」が注目されています。がん微小環境はがんの進展とともにダイナミックに変動して、がんの増殖・浸潤・転移に深くかかわっていると考えられるようになりました。
私たちは、がん微小環境の本体である細胞外マトリックスを分解するマトリックス分解酵素 matrix metalloproteinase (MMP) の一つADAMTSが腫瘍血管新生に果たす役割に注目し研究を行っています(保健学科 廣畑研究室との共同研究)。